(KDDF-201410-08) 신규 뇌졸중 치료제 JPI-289의 임상 IB상 개발 연구
중추신경, 합성
급성기허혈성 뇌졸중(acute ischemic stroke) 치료제로서 first-in-class의 PARP-1 저해제인 JPI-289의 임상 Ib시험(반복투여)을 통하여 인체 내 안전성/내약성 및 약동학/약력학적 특성을 평가하고 임상 IIa IND 승인을 획득할 예정이다.
Proof of Concept (POC) 임상(임상 IIa상)을 신속하게 완료한 후 제일약품은 궁극적으로 글로벌 제약사에 JPI-289를 기술이전하고(Licensing-out), 공동 개발 및 상업화를 진행할 계획이다.
뇌졸중은 암에 이어 사망률 2-3위의 질환이며, 단일 질환으로는 사망률 1위 질환으로, 지난 수십 년간 현대의학의 발전에도 불구하고 세계 인구의 노령화로 인해 뇌졸중 환자수는 향후 20여 년에 걸쳐 계속해서 증가할 것으로 전망된다.
우리나라 뇌졸중 발병률은 세계 1위임에도 불구하고 현재까지 임상적으로 치료 효과가 우수한 약물이 없어 신규 치료제의 개발 및 의학적인 치료(medical care)가 절실히 요구되고 있다.
현재, 혈류장애에 의한 허혈성 뇌졸중 치료는 대부분 혈전용해제(thrombolytic agent)와 시술로 이루어지고 있으며 항응고제(anticoagulant), 혈소판 응집 억제제(platelet aggregation inhibitor)등 다양한 약물들이 이차예방에 사용되고 있으나, 시장성이 큰 치료제 분야임에도 불구하고 아직까지 미국 FDA에서 승인한 치료제는 혈전용해제인 tissue Plasminogen Activator (tPA)가 유일하다.
제일약품은 신규 뇌졸중 치료제로서 PARP-1 저해제인 JPI-289를 임상 IIa에서 tPA와 병용투여하여 임상적 POC(Proof of Concept)을 확보한 후 글로벌 제약사에 기술이전(Licensing-out)하고 공동개발을 추진하는 동시에 국내에서의 조속한 상용화를 진행할 예정이다.
tPA 병용투여를 위한 homogeneous환자군을 선택하여 NDA 승인을 획득한 후 PMS 임상을 통해 대상환자군 및 적응증을 확대할 계획이다.
식품의약품안전처(MFDS) 및 아산병원 IRB로부터 건강한 성인을 대상으로 임상 Ib (MAD, Multiple Ascending Dose)에 대한 임상시험계획서 승인을 받았으며, 당해 년도에 진행할 예정이다. 2015년에 뇌졸중 환자를 대상으로 임상 IIa에 대한 임상시험계획서를 개발할 예정이며, 향후 임상 Ib의 완료와 더불어 그 결과를 반영한 계획서의 IND승인을 획득하고, 2016년 초 임상 IIa상(POC 임상) 시험에 진입할 예정이다.
물질 및 제법 특허의 경우 2008년도에 선 출원 후 2011년도 한국특허 등록(10-0968175)을 필두로 2011~14년에 미국, 유럽, 중국, 일본, 호주, 캐나다 및 러시아에 특허가 등록 되었다.
- PCT: WO 2010/056038
2012년에 JPI-289 결정형 특허 1건을 별도로 출원하였다.
현재 국내 1건과 국외 7건에 대해 JPI-289 관련 특허가 등록 완료되었으며, 이외에 국내 1건과 국외 7건의 특허가 출원되어 등록과정이 진행 중이다.
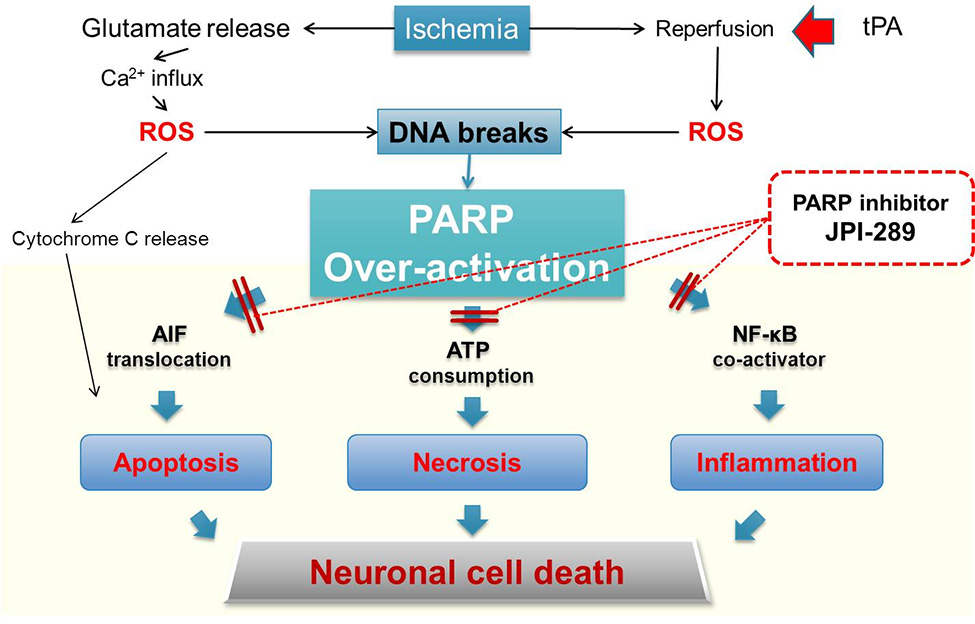
이제까지의 100여개 임상약물들은 대부분 apoptosis를 차단하는 작용기작으로 치료효과를 보이려 하였으나, 뇌졸중 발병 후 초기 10시간 까지는 necrosis에 의한 뇌손상이 주로 일어나기 때문에 임상적으로 큰 효과를 보기 어려웠다.
PARP-1 저해제인 JPI-289는 아래의 그림에 나타낸 것처럼 뇌졸중으로 인해 발생하는 뇌세포 괴사로 인한 세포사멸(necrosis) 및 apoptosis와 inflammation을 동시에 억제할 수 있는 새로운 기전의 약물로서, 임상적으로 큰 치료효과를 기대할 수 있으며 획기적인 뇌졸중 치료 수단을 제공할 수 있다.
당사 개발후보의 차별적 강점
① JPI-289는 PARP-1 저해 활성을 가진 새로운 기전의 약물로 뇌졸중의 다양한 기전을 억제할 수 있어 기존에 개발이 시도되었던 약물들과는 달리 임상시험에서 허혈성 뇌졸중 환자들을 대상으로 치료 및 뇌신경세포 보호효과를 보일 수 있을 것으로 기대된다.
② JPI-289의 작용기전인 PARP-1 저해는 미쯔비시 다나베 사의 MP-124에 의해 사람의 뇌와 가장 유사한 영장류(monkey) 동물모델에서 효력이 있음이 입증됨으로써, 임상적 효력(Clinical Proof of Concept)을 보여줄 가장 유망한 작용기전으로 기대되고 있으며, JPI-289는 monkey 동물모델시험에서 MP-124 대비 2배 이상의 효능을 확보하여 세계 최고 수준의 원숭이 동물모델효력(뇌경색용적 49% 감소 효과)을 보유하게 되어 임상 성공 가능성이 높을 것으로 예상된다.
③ JPI-289는 임상 Ia시험 동안 중대한 이상반응이 발생하지 않아 인체 내 안전성을 확인했고, 약동학평가 결과 용량의존적으로 AUC가 증가함을 보였다.
④ JPI-289는 물에 대한 용해도가 뛰어나고, PK시험 결과 물성이 우수하여 단회투여만으로도 SD rat 뇌졸중 동물모델에서 뇌경색용적(infarct volume)을 유의적으로 감소시켰다. 따라서, 신속한 투약과 치료가 요구되는 급성기허혈성 뇌졸중 환자에게 적합한 치료약물이 될 것으로 기대된다(JPI-289 1 h iv infusion vs. MP-124 24 h iv infusion).
⑤ Rat 색전성뇌졸중모델에서 tPA와 병용투여 시 우수한 뇌경색용적 감소효과와 tPA에 의한 출혈 감소효과를 확인함으로써 임상에서 tPA와 병용투여 할 근거를 확보했다.
⑥ JPI-289는 정맥투여제로 개발되고 있으나 생체이용률도 높게 나타나(66%) 경구 투여제로도 개발이 가능하여 퇴원 후에도 치료효과의 극대화를 기대할 수 있다.
⑦ JPI-289는 비임상시험 결과 안전성이 입증되어 건강한 사람을 대상으로 임상 I상을 수행하도록 IND 승인을 받아 선발주자인 MP-124 (2009년부터 뇌졸중 환자들을 대상으로 임상 I상시험 중임)와의 시간적 격차를 획기적으로 줄일 수 있으며, 임상 IIa를 국내에서 신속히 진행하여 Clinical POC를 확보함으로써 글로벌 제약사들과의 기술이전계약에 있어 유리한 고지를 점유할 수 있을 것으로 기대된다.
⑧ Clinical POC 입증 후 대상환자군과 적응증(심근경색 등)을 확대함으로써 약물의 가치를 극대화하고자 한다.
⑨ 시기별 S100B 또는 NSE 농도와 MRI로 측정된 뇌경색용적과의 correlation이 유의미한 결과를 보여 이 두 지표가 JPI-289의 바이오마커로 개발될 수 있는 가능성을 확인하였다.
⑩ 합성 공정이 확립되어 cGMP시설에서 임상 I상용 DS, DP가 생산되었으며, 상업적 대량생산이 가능하다.
⑪ 2029년까지 독점적 시장지배 권리를 행사할 수 있어 큰 시장가치를 확보하였다.
신경계질환 (뇌졸중)
2015. 02. 01 - 2015. 11. 30
제일약품㈜
임상 1b상